- Explica la hipótesis de Symmer acerca del fluido vítreo y el fluido resinoso
2. ¿Que es un tubo de descarga?
Es un tubo, normalmente de forma cilíndrica, donde se producen las descargas eléctricas entre los electrodos. Está relleno con un gas (vapor de mercurio o sodio habitualmente) a alta o baja presión que determina las propiedades de la lámpara. En las lámparas fluorescentes se recubre la cara interna con sustancias fluorescentes que convierten las emisiones ultravioletas en luz visible. Los materiales que se emplean en su fabricación dependen del tipo de lámpara y de las condiciones de uso. 
Los rayos catódicos son corrientes de electrones observados en tubos de vacío, es decir los tubos de cristal que se equipan por lo menos con dos electrodos, un cátodo (electrodo negativo) y un ánodo (electrodo positivo) en una configuración conocida como diodo. Cuando se calienta el cátodo, emite una cierta radiación que viaja hacia el ánodo. Si las paredes internas de vidrio detrás del ánodo están cubiertas con un material fluorescente, brillan intensamente. Una capa de metal colocada entre los electrodos proyecta una sombra en la capa fluorescente. Esto significa que la causa de la emisión de luz son los rayos emitidos por el cátodo al golpear la capa fluorescente. Los rayos viajan hacia el ánodo en línea recta, y continúan más allá de él durante una cierta distancia. Este fenómeno fue estudiado por los físicos a finales del siglo XIX. Gracias al experimento Joseph John Thomson estudió el comportamiento y los efectos de los rayos catódicos. En sus experimentaciones observó que cuando en un tubo de vidrio que lleva soldados dos electrodos conectados a una gran tensión (de 20000 a 100000 voltios) se hace el vacío (aproximadamente 0,001 mmHG), al producirse una descarga se aprecia una luminosidad o fluorescencia verdosa en la pared localizada frente al cátodo, que los investigadores supusieron que era debida a la existencia de unos rayos procedentes del electrodo negativo, que llamaron rayos catódicos. El físico inglés J.J Thomson, en 1897, al estudiar las propiedades y los efectos de los rayos catódicos, dedujo inicialmente su carácter corpuscular y su naturaleza eléctrica negativa.Una vez hecho el estudio de la relación carga/masa para tales partículas, se obtuvo siempre el mismo valor (1,758796 × 1011 C/kg) fueran cuales fuesen las condiciones en las que se produjeran los rayos y la naturaleza del gas encerrado en el tubo. A propuesta del físico irlandés George Johnstone Stoney, se bautizó a estas partículas con el nombre de electrones, suponiéndolas como partículas elementales de la electricidad o, como se dice en la actualidad, cargas eléctricas elementales.
Posteriores investigaciones de Milikan, en 1913, y de Hopper y Labby, en 1941, permitieron obtener el valor de la carga eléctrica que poseen, así como también deducir su masa.
- Carga del electrón: -1,602 × 10-19 C
3.Modelo de thomson
:l modelo atómico de Thomson es una teoría sobre la estructura atómica propuesta en 1904 por Joseph John Thomson, quien descubrió el electrón en 1897, La primera evidencia de la existencia de partículas subatómicas y por tanto de que los átomos no eran indivisibles como postulaba la teoría atómica de Dalton, se obtuvo de los estudios de la conductividad eléctrica de gases a bajas presiones.Los gases son aislantes para voltajes bajos, sin embargo, frente a voltajes elevados se vuelven conductores. Cuando en un tubo de vidrio que contiene un gas se hace parcialmente el vacío y se aplica un voltaje de varios miles de voltios, fluye una corriente eléctrica a través de él. Asociado a este flujo eléctrico, el gas encerrado en el tubo emite unos rayos de luz de colores, denominados rayos catódicos, que son desviados por la acción de los campos eléctricos y magnéticos.Mediante un estudio cuidadoso de esta desviación, J. J. Thomson demostró en 1897 que los rayos estaban formados por una corriente de partículas cargadas negativamente, que llamó electrones.En dicho modelo, el átomo está compuesto por electrones de carga negativa en un átomo positivo, embebidos en éste al igual que las pasas de un budín. A partir de esta comparación, fue que el supuesto se denominó "Modelo del budín de pasas".Postulaba que los electrones se distribuían uniformemente en el interior del átomo suspendidos en una nube de carga positiva. El átomo se consideraba como una esfera con carga positiva con electrones repartidos como pequeños gránulos. La herramienta principal con la que contó Thomson para su modelo atómico fue la electricidad. Pero este modelo fue cambiando sucesivamente primero por Rutherford en el que se basaba en los resultados obtenidos en sus experimentos de bombardeo de láminas delgadas de metales, stableció el llamado modelo atómico de Rutherford o modelo atómico nuclear y gracias a ellos dedujo que el atomo tiene que estar formado por dos partes el núcleo que seria la parte central, de tamaño muy pequeño, donde se encuentra la cortez
a positiva y pracicamente, toda la masa del átomo, y la corteza es casi un espacio vacío, inmenso en ralción con las dimensiones del núcleo.
Y finalmente Niels Bohr con su modelo atómico en el que establece asi, que los electrones solo pueden girar en ciertas óritas de radios determinados. estas órbitas sonestacionarias, en ellas el electron no emite energía: la energía cinética del electrón equilibra exactamente la atraccion electrostática entre las cargas opuestas de núcleo y electrón. SIn embargo el modelo atómico de Bohr también tuvo que ser abandonado al no poder explicar los espectros de átomos más complejos. La idea de que los electrones se mueven alrededor del núcleo en órbitas definidas tuvo que ser ddesechada. Las nuevas ideas sobre el átomo están basadas en la mécanica cuántica, que el propio Bohr contribuyó a desarrollar.
:l modelo atómico de Thomson es una teoría sobre la estructura atómica propuesta en 1904 por Joseph John Thomson, quien descubrió el electrón en 1897, La primera evidencia de la existencia de partículas subatómicas y por tanto de que los átomos no eran indivisibles como postulaba la teoría atómica de Dalton, se obtuvo de los estudios de la conductividad eléctrica de gases a bajas presiones.Los gases son aislantes para voltajes bajos, sin embargo, frente a voltajes elevados se vuelven conductores. Cuando en un tubo de vidrio que contiene un gas se hace parcialmente el vacío y se aplica un voltaje de varios miles de voltios, fluye una corriente eléctrica a través de él. Asociado a este flujo eléctrico, el gas encerrado en el tubo emite unos rayos de luz de colores, denominados rayos catódicos, que son desviados por la acción de los campos eléctricos y magnéticos.Mediante un estudio cuidadoso de esta desviación, J. J. Thomson demostró en 1897 que los rayos estaban formados por una corriente de partículas cargadas negativamente, que llamó electrones.En dicho modelo, el átomo está compuesto por electrones de carga negativa en un átomo positivo, embebidos en éste al igual que las pasas de un budín. A partir de esta comparación, fue que el supuesto se denominó "Modelo del budín de pasas".Postulaba que los electrones se distribuían uniformemente en el interior del átomo suspendidos en una nube de carga positiva. El átomo se consideraba como una esfera con carga positiva con electrones repartidos como pequeños gránulos. La herramienta principal con la que contó Thomson para su modelo atómico fue la electricidad. Pero este modelo fue cambiando sucesivamente primero por Rutherford en el que se basaba en los resultados obtenidos en sus experimentos de bombardeo de láminas delgadas de metales, stableció el llamado modelo atómico de Rutherford o modelo atómico nuclear y gracias a ellos dedujo que el atomo tiene que estar formado por dos partes el núcleo que seria la parte central, de tamaño muy pequeño, donde se encuentra la cortez
a positiva y pracicamente, toda la masa del átomo, y la corteza es casi un espacio vacío, inmenso en ralción con las dimensiones del núcleo.
Y finalmente Niels Bohr con su modelo atómico en el que establece asi, que los electrones solo pueden girar en ciertas óritas de radios determinados. estas órbitas sonestacionarias, en ellas el electron no emite energía: la energía cinética del electrón equilibra exactamente la atraccion electrostática entre las cargas opuestas de núcleo y electrón. SIn embargo el modelo atómico de Bohr también tuvo que ser abandonado al no poder explicar los espectros de átomos más complejos. La idea de que los electrones se mueven alrededor del núcleo en órbitas definidas tuvo que ser ddesechada. Las nuevas ideas sobre el átomo están basadas en la mécanica cuántica, que el propio Bohr contribuyó a desarrollar.
4.Michelson y Morley
El experimento de Michelson y Morley fue uno de los más importantes y famosos de la historia de la física. Realizado en 1887 por Albert Abraham Michelson y Edward Morley, está considerado como la primera prueba contra la teoría del éter. El resultado del experimento constituiría posteriormente la base experimental de la teoría de la relatividad especial de Einstein.
El experimento consiste en lo siguiente:
en la base de un edificio cercano al nivel del mar, Michelson y Morley construyeron lo que se conoce como elinterferómetro,es un instrumento que emplea la interferencia de las ondas de luz para medir con gran precisión longitudes de onda de la misma luz. Se compone de una lente semiplateada o semiespejo, que divide la luz monocromática en dos haces de luz que viajan en un determinado ángulo el uno respecto al otro.

En este caso el protagonista es Niels Borh, que como deciamos antes es un gran cientifico, que se conoce principalmente por su modelo atómico el que los electrones solo pueden girar en ciertas óritas de radios determinados. estas órbitas sonestacionarias, en ellas el electron no emite energía: la energía cinética del electrón equilibra exactamente la atraccion electrostática entre las cargas opuestas de núcleo y electrón. SIn embargo el modelo atómico de Bohr también tuvo que ser abandonado al no poder explicar los espectros de átomos más complejos. La idea de que los electrones se mueven alrededor del núcleo en órbitas definidas tuvo que ser ddesechada. Las nuevas ideas sobre el átomo están basadas en la mécanica cuántica, que el propio Bohr contribuyó a desarrollar.El electrón solo puede tomar así los valores de energía correspondientes a esas órbitas. los saltos de los electrones desde niveles de mayor energía a otros de menos energía o vicervesa suponen,respectivamente, una emisión o una absorción de energía electromagnética(fotones de luz). Por ello los rayos X ionizan las gotas de aceite porque los átomos de cada gota al recibir los rayos, van llenando de electrones sus capas hasta que no queda ningún espacio libre.

en esta imagen podemos ver como el átomo esta formado por un núcleo en el que estan los protones y neutrones y que alrededor hay unas orbitas donde estan los electrones , estas orbitas tienen que estaerorganizadas de tal manera que no colisionen entre si los electrones.
6- Describe el experimento de Millikan. Propongo el siguiente trabajo opcional: realiza el experimento en esta web y presenta los resultados que hayas obtenido (gráficas, cálculos, etc…).

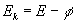
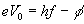
El experimento consiste en lo siguiente:
en la base de un edificio cercano al nivel del mar, Michelson y Morley construyeron lo que se conoce como elinterferómetro,es un instrumento que emplea la interferencia de las ondas de luz para medir con gran precisión longitudes de onda de la misma luz. Se compone de una lente semiplateada o semiespejo, que divide la luz monocromática en dos haces de luz que viajan en un determinado ángulo el uno respecto al otro.
Con esto se lograba enviar simultáneamente dos rayos de luz (procedentes de la misma fuente) en direcciones perpendiculares, hacerles recorrer distancias iguales (o caminos ópticos iguales) y recogerlos en un punto común, en donde se crea un patrón de interferencia que depende de la velocidad de la luz en los dos brazos del interferómetro. Cualquier diferencia en esta velocidad (provocada por la diferente dirección de movimiento de la luz con respecto al movimiento del éter) sería detectada.
La distancia entre los espejos y el semiespejo tiene una longitud "L", es decir, el "Recorrido 1" es igual al "Recorrido 2".

- Para los que no lo saben el éter era una hipotética sustancia extremadamente ligera que se creía que ocupaba todos los espacios como un fluido.
En este caso el protagonista es Niels Borh, que como deciamos antes es un gran cientifico, que se conoce principalmente por su modelo atómico el que los electrones solo pueden girar en ciertas óritas de radios determinados. estas órbitas sonestacionarias, en ellas el electron no emite energía: la energía cinética del electrón equilibra exactamente la atraccion electrostática entre las cargas opuestas de núcleo y electrón. SIn embargo el modelo atómico de Bohr también tuvo que ser abandonado al no poder explicar los espectros de átomos más complejos. La idea de que los electrones se mueven alrededor del núcleo en órbitas definidas tuvo que ser ddesechada. Las nuevas ideas sobre el átomo están basadas en la mécanica cuántica, que el propio Bohr contribuyó a desarrollar.El electrón solo puede tomar así los valores de energía correspondientes a esas órbitas. los saltos de los electrones desde niveles de mayor energía a otros de menos energía o vicervesa suponen,respectivamente, una emisión o una absorción de energía electromagnética(fotones de luz). Por ello los rayos X ionizan las gotas de aceite porque los átomos de cada gota al recibir los rayos, van llenando de electrones sus capas hasta que no queda ningún espacio libre.
en esta imagen podemos ver como el átomo esta formado por un núcleo en el que estan los protones y neutrones y que alrededor hay unas orbitas donde estan los electrones , estas orbitas tienen que estaerorganizadas de tal manera que no colisionen entre si los electrones.
6- Describe el experimento de Millikan. Propongo el siguiente trabajo opcional: realiza el experimento en esta web y presenta los resultados que hayas obtenido (gráficas, cálculos, etc…).
Millikan desarrolló un experimento que consiste en introducir, mediante un atomizador, gotitas de aceite (del orden del micrómetro) en un medio gaseoso controlado, con una viscosidad determinada, y entre dos placas conectadas a una fuente de tensión. Algunas gotitas, por efecto de la fricción con el atomizador, reciben cierta carga electrostática —o alternativamente, se cargan mediante una fuente externa de radiación ionizante (rayos X)—. El campo eléctrico producido por las placas, vertical y hacia arriba, se opone a la fuerza de la gravedad y algunas gotas quedan en equilibrio. Entonces, se escoge una gota con la que trabajar y se descartan las demás apagando y encendiendo la fuente de tensión.

Imagen extraída de la Wikipedia.
Una vez seleccionada la gota, se apaga el campo eléctrico; esta cae lentamente alcanzando rápidamente una velocidad terminal. Cuando esto sucede, significa que la fuerza de arrastre es igual y opuesta a la fuerza de la gravedad; así pues, igualando la ecuación de la fuerza de arrastre (que contiene la viscosidad, el radio de la gota supuesta esférica, y la velocidad terminal) y la ecuación del peso de la gota (que continene las densidades del gas y el aceite, la constante gravitatoria y el radio al cubo), podemos extraer el radio de la gota.
En este momento se vuelve a activar el campo eléctrico. Evidentemente, ajustarlo de manera que la gota quede en equilibrio sin moverse es muy complicado. Por ello, una buena práctica es aumentarlo de manera que la gota comience a subir: en la nueva ecuación, el peso (hacia abajo) más la fuerza de arrastre (hacia abajo) son iguales a la fuerza del campo eléctrico (hacia arriba). De nuevo, alcanza otra velocidad terminal que introducida en la ecuación anterior, junto con el radio averiguado antes, nos proporciona la carga eléctrica de la gota.
Repitiendo este procedimiento muchas veces con múltiples gotas de diferentes tamaños, Millikan llegó al resultado de que la carga eléctrica siempre toma un valor igual a un múltiplo entero de una carga elemental: la del electrón.
7- ¿Qué es el efecto fotoeléctrico?
La emisión de electrones por metales iluminados con luz de determinada frecuencia fue observada a finales del siglo XIX por Hertz y Hallwachs. El proceso por el cual se liberan electrones de un material por la acción de la radiación se denomina efecto fotoeléctrico o emisión fotoeléctrica. Sus características esenciales son:
- Para cada sustancia hay una frecuencia mínima o umbral de la radiación electromagnética por debajo de la cual no se producen fotoelectrones por más intensa que sea la radiación. La emisión electrónica aumenta cuando se incrementa la intensidad de la radiación que incide sobre la superficie del metal, ya que hay más energía disponible para liberar electrones.
En los metales hay electrones que se mueven más o menos libremente a través de la red cristalina, estos electrones no escapan del metal a temperaturas normales por que no tienen energía suficiente. Calentando el metal es una manera de aumentar su energía. Los electrones "evaporados" se denominan termoelectrones, este es el tipo de emisión que hay en las válvulas electrónicas. Vamos a ver que también se pueden liberar electrones (fotoelectrones) mediante la absorción por el metal de la energía de radiación electromagnética.
El objetivo de la práctica simulada es la determinación de la energía de arranque de los electrones de un metal, y el valor de la constante de Planck. Para ello, disponemos de un conjunto de lámparas que emiten luz de distintas frecuencias y placas de distintos metales que van a ser iluminadas por la luz emitida por esas lámparas especiales.
- Sea f la energía mínima necesaria para que un electrón escape del metal. Si el electrón absorbe una energía E, la diferencia E-f, será la energía cinética del electrón emitido.
- Einstein explicó las características del efecto fotoeléctrico, suponiendo que cada electrón absorbía un cuanto de radiación o fotón. La energía de un fotón se obtiene multiplicando la constante h de Planck por la frecuencia f de la radiación electromagnética.
E=hf
- Si la energía del fotón E, es menor que la energía de arranque f, no hay emisión fotoeléctrica. En caso contrario, si hay emisión y el electrón sale del metal con una energía cinética Ek igual a E-f.
- Por otra parte, cuando la placa de área S se ilumina con cierta intensidad I, absorbe una energía en la unidad de tiempo proporcional a IS, basta dividir dicha energía entre la cantidad hf para obtener el número de fotones que inciden sobre la placa en la unidad de tiempo. Como cada electrón emitido toma la energía de un único fotón, concluimos que el número de electrones emitidos en la unidad de tiempo es proporcional a la intensidad de la luz que ilumina la placa

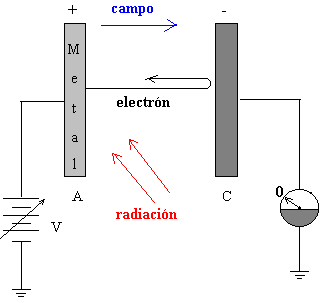
Mediante una fuente de potencial variable, tal como se ve en la figura podemos medir la energía cinética máxima de los electrones emitidos, véase el movimiento de partículas cargadas en un campo eléctrico.
Aplicando una diferencia de potencial V entre las placas A y C se frena el movimiento de los fotoelectrones emitidos. Para un voltaje V0 determinado, el amperímetro no marca el paso de corriente, lo que significa que ni aún los electrones más rápidos llegan a la placa C. En ese momento, la energía potencial de los electrones se hace igual a la energía cinética.
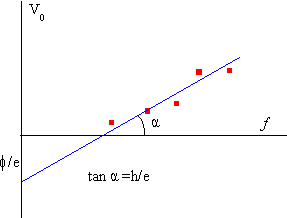
Variando la frecuencia f, (o la longitud de onda de la radiación que ilumina la placa) obtenemos un conjunto de valores del potencial de detención V0. Llevados a un gráfico obtenemos una serie de puntos (potencial de detención, frecuencia) que se aproximan a una línea recta.
La ordenada en el origen mide la energía de arranque en electrón-voltios f/e. Y la pendiente de la recta es h/e. Midiendo el ángulo de dicha pendiente y usando el valor de la carga del electrón e= 1.6 10-19 C, obtendremos el valor de la constante de Planck, h=6.63 10-34 Js.

8Por qué piensas que es interesante que los científicos pasen algunos años en otros centros de investigación distintos a los que se formaron?¿Y por qué es recomendable (o no) leer libros de divulgación científica?
Porque de esa manera pueden contrastar sus experimentos y opiniones con los de otros cientificos y de esa forma obtener nuevas ideas y datos para sus proximos experimentos que vayan a realizar. Mi grupo y yo pensamos que a leer un libro de divulgación cientifica es una manera mas facil de asimilar conceptos y aprender nuevas cosas de una manera más fácil y entrentenida.
file:0- Construyfile:con materiales reutilizados tu propio modelo atómico (Thomson, Rutherford o Bohr).
nosotros hemos decidido construir uno parecido al de Thomson; lo que realizamos fue lo siguiente cogimos una bolsa que sirva para dar calor y frio y pusimos capsulas de café, de tal forma que la bolsa sea el átomo, que tiene una carga positiva y sobre ella estan las capsulas que son los electrones la carga negaiva 



